مطالعه تطبیقی اسمولاریته در مقابل اسمولالیته در مقابل تونیسیته
به گزارش ایران کلام، سردرگمی زیادی میان اصطلاحات اسمولاریته، اسمولالیته و تونیسیته وجود دارد که به اشتباه به جای هم استفاده می شوند. این مقاله این اصطلاحات را با بیان تفاوت های بین آنها به همراه مثال ها و نحوه محاسبه آنها شرح می دهد.
سردرگمی زیادی میان اصطلاحات اسمولاریته، اسمولالیته و تونیسیته وجود دارد که به اشتباه به جای هم استفاده می شوند. این مقاله این اصطلاحات را با بیان تفاوت های بین آنها به همراه مثال ها و نحوه محاسبه آنها شرح می دهد.
آیا می دانستید که اصطلاحات اسمولاریته و اسمولالیته هنگام کار با فیزیولوژی انسان آزادانه قابل تعویض هستند. اولی با 1 لیتر محلول سرو کار دارد، در حالی که دومی شامل 1 کیلوگرم حلال است. در بدن انسان، این محلول، پلاسما است که وقتی رقیق می گردد تقریباً شبیه آب است که حلال است. بعلاوه 1 لیتر آب 1 کیلوگرم وزن دارد.
هنگامی که دو محلول با غلظت های مختلف به وسیله یک غشای نیمه تراوا از هم جدا می شوند، آنگاه مولکول های حلال از محلول رقیق به محلول غلیظ از میان غشاء منتقل می گردد. این اتفاق تا زمانی می افتد که هر دو محلول از غلظت برابر برخوردار شوند. به این فرآیند اسمز گفته می گردد و نمونه هایی از غشاهایی که از این سو به آن سوی آنها این اتفاق می تواند رخ دهد شامل لایه های مضاعف چربی، غشاهای پلی آمید و حتی غشاهای پلاسمایی سلول های انسانی است.
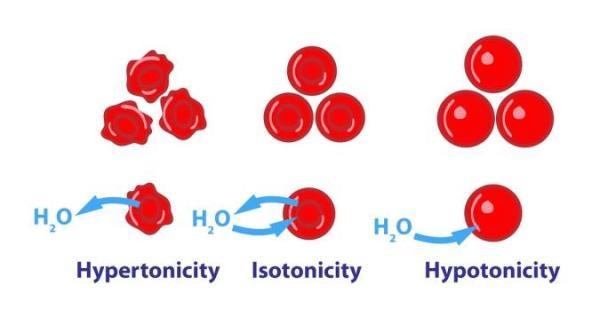
اسمز، هنگامی که در سلول های انسانی رخ می دهد، می تواند عواقب مهمی داشته باشد. این امر می تواند باعث متورم شدن و ترکیدن گلبول های قرمز گردد، که همولیز نامیده می گردد، یا در موارد دیگر باعث کوچک شدن و منقبض شدن آنها می گردد. با این وجود بدن انسان برای جلوگیری از بروز چنین از شکل افتادگی هایی مجهز به طیف وسیعی از سازوکارهای داخلی است و پایداری اسمزیک، به نام هموستاز، را حفظ می نماید.
برای حفظ چنین پایداری ای، بدن از پدیده ای به نام فشار اسمزی استفاده می نماید. این حداقل فشاری است که باید برای جلوگیری از جریان حلال از یک غشای نیمه تراوا اعمال گردد. در اصل، به این معنی است که یک محلول با فشار اسمزی بالا، حلال بیشتری را به سمت خود جذب می نماید. این اصطلاح را می توان با استفاده از مفاهیم اسمولاریته و اسمولالیته، که با تعداد ذرات موجود در محلول سروکار دارند، بهتر شرح داد، در حالی که تونیسیته به ما یاری می نماید تا تأثیر چنین املاحی را بر روی سلول ها درک کنیم. تفاوت بین اسمولاریته، اسمولالیته و تونیسیته در زیر بیشتر شرح داده شده است.
اسمولاریته
اسمولاریته روشی است که برای نشان دادن غلظت محلول اسمزی از آن استفاده می گردد. به صورت تعداد اسمول های یک جسم حل شده در یک لیتر محلول تعریف می گردد. اصطلاح اسمول تعداد ذرات جسم حل شده موجود در محلول را نشان می دهد. بسته به این که اجزای محلول از هم جدا گردد یا خیر، ممکن است این ذرات مولکول یا یون باشند.به طور کلی فرمول اسمولاریته برای محلول با یک نوع جسم حل شده عبارت است از:
اسمولاریته = تعداد مول های یک لیتر × تعداد ذرات اسمزی فعال در هر مول
به عنوان مثال، اسمولاریته 1 مول NaCl دو اسمول در لیتر است. این امر به این علت است که NaCl به دو یون تقسیم می گردد، Na + و Cl-، که اسمول های آن هستند. اسمولاریته 1 مول گلوکز 1 اسمول در لیتر است، زیرا گلوکز غیر یونی است و شکافته نمی گردد و بنابراین، 1 مول تنها 1 اسمول را نشان می دهد.
اسمولاریته یک خاصیت ائتلافی است، به این معنی که به تعداد ذرات حل شده در محلول بستگی دارد و نه وزن آنها. از آن جا که حجم اشغال شده به وسیله هر دو ذرات جسم حل شده و حلال در محلول با تغییر دما تغییر می نماید، معین اسمولاریته می تواند سخت باشد. واحد آن osmol / L یا Osm / L است.
بر اساس اسمولاریته آنها، محلول ها می توانند به این موارد تقسیم شوند:
* هایپراسموتیک: به یک محلول که تعداد اسمول بیشتری در لیتر نسبت به نوع دیگر دارد، گفته می گردد نسبت به آن هایپراسموتیک است.
* هیپوسموتیک: به یک محلول که تعداد اسمول کمتری در لیتر نسبت به دیگری دارد، گفته می گردد که نسبت به آن هیپوسموتیک است.
* ایزوسموتیک: دو محلول که یک تعداد اسمول در یک لیتر دارند، گفته می گردد که نسبت به هم ایزوسموتیک هستند.
اسمولالیته
از اسمولالیته برای نمایش غلظت یک محلول اسمزی بر اساس تعداد ذرات، در ارتباط با وزن حلال استفاده می گردد. به طور خاص، تعداد اسمول در هر کیلوگرم حلال است. بنابراین، تفاوت بین ماده حل شده و حلال را به روشی بهتر نشان می دهد.از آن جا که وزن حلال با درجه حرارت تغییر نمی نماید، اسمولالیته در کاربردهای کلینیکی نسبت به اسمولاریته ترجیح داده می گردد، و بعلاوه به علت این که اندازه گیری حجم مایعات بیمار نسبت به اندازه گیری وزن آن مایعات سختتر است.
واحد اسمولالیته osmol/kg یا Osm/kg است. از آن جا که پلاسمای خون انسان حاوی اندازه زیادی یون سدیم است، فرمول اسمولالیته آن عبارت است از:
اسمولالیته پلاسما (هنگامی که سطح گلوکز تحت کنترل است) = دو ضرب در سطح سدیم
در محاسبه اسمولالیته، فقط وزن حلال در نظر گرفته می گردد، در حالی که در اسمولاریته، هم حجم جسم حل شده و هم حجم حلال در نظر گرفته می گردد. به همین علت است که ارزش دومی کمی کمتر از اولی است. هنگامی که دو محلول با غلظت های مختلف به وسیله یک غشای نیمه تراوا از هم جدا می شوند، آنگاه مولکول های حلال از محلول رقیق به محلول غلیظ از میان غشاء منتقل می گردد. مایعات بدن بیشتر از آب تشکیل شده اند و وزن یک لیتر آب تقریباً برابر با یک کیلوگرم است. بنابراین، اصطلاحات اسمولاریته و اسمولالیته در فیزیولوژی انسان آزادانه به جای هم استفاده می گردد. اندازه اسمولاریته و اسمولالیته مایعات بدن انسان به ترتیب در بازه 270 تا 300 mOsm / L یا mOsm / kg است.
تونیسیته
تونیسیته، اسمولالیته یک محلول در ارتباط با یک غشای نیمه تراواست. غلظت آن ذرات از جسم حل شده است که نمی توانند از غشا عبور نمایند، یعنی برای یک غشای داده شده غیرقابل نفوذ هستند. بنابراین، تونیسیته نه تنها به خواص ماده حل شده بستگی دارد، بلکه به خصوصیات غشای مورد نظر هم بستگی دارد. تونیسیته بعلاوه به عنوان غلظت نسبی یک محلول در خارج از یک سلول در ارتباط با غلظت آن در داخل سلول تعریف می گردد.هنگامی که یک محلول حاوی مخلوطی از املاح نفوذ پذیر و غیرقابل نفوذ است، آنگاه تونیسیته فقط با آن دسته از املاح که از غشاء عبور نمی نمایند سروکار دارد، در حالی که بقیه که از آن عبور می نمایند در نظر گرفته نمی شوند. از آن جا که یون های سدیم غیرقابل نفوذ، اسمول های اصلی در یک مایع خارج از سلول است، تونیسیته به طور مؤثر برابر با اسمولالیته سلول های بدن است.
منبع: آکشای چاوان - ساینس استراک
منبع: راسخون